






对于刚刚从事骨科基础研究的同行来言,项目开展的第一项内容往往是运用放射学手段(如X-射线、μCT)对小鼠骨骼结构进行器质性的物理分析,从而确立其生理/病理表型,以便开展后续的深入研究。通常在获得表型这个“激动人心“的时刻,我们往往面临着一个研究方向的抉择:“成骨化进程还是破骨化进程,亦或是两者兼之”,以及随之而来的技术难题-骨组织形态计量学分析(Histomorphometry)。虽然像高分辨率μCT这样的先进成像技术可以提供关于骨量和骨结构方面精准信息,但它们目前还不能代替骨组织形态计量学为研究人员提供骨骼系统中细胞层面的参数信息。那么,什么是骨组织形态计量学?其核心竞争力又表现在哪些方面呢?简而言之,骨组织形态计量学其实就是基于非脱钙骨组织学切片的病理学分析手段, 可以取得关于骨结构、骨形成、骨吸收、骨矿化以及骨重塑等多重定量信息,广泛应用于代谢性骨病发生/发展机制、抗骨质疏松症药物研发等。
之所以我们觉得骨组织形态计量学不容易掌握,究其缘由主要是因为骨骼系统作为机体物理性质最为特殊的组织结构,含有碱性磷酸钙的无机质成分,坚硬挺实,需要不同于传统石蜡切片的处理流程。由于其样品处理较为繁琐,掌握和使用人群较为小众,国内开展时间较晚,所以大家对骨组织形态计量学的步骤、细节和注意事项等还不是很熟悉和了解。在此,本人有幸受到国际华人骨研会(ICMRS)的邀请,结合十多年来在骨组织形态计量学工作中的一些经验和小小体会,以小鼠骨骼样本为例,给大家初步剖析一下其包含的核心内容(主要包括硬组织包埋和切片、骨组织形态特异性染色、分析软件及其参数选取这三大方面),供初学者理解和参考;若有不足之处,也恳请广大骨科学人批评、指正。
硬组织包埋和切片
首先对于骨组织形态计量学分析中的“难中之难”,我想首当其冲的应该就是大部分医院/高校的病理平台还无法独立完成的“黑”技术-非脱钙硬组织切片技术。目前,江湖上骨非脱钙切片的技术手段大抵分为三大“流派”:传统树脂包埋切片法、冰冻贴膜切片法、可视化激光无损组织切片技术。由于激光切割法的基础也是基于样本的树脂包埋,对硬件和成本要求都比较高,也有商业化的公司在专门运行,在此我就不再赘述。(有兴趣的同学可以参考德国的LLS ROWIAK 公司的服务内容,https://www.lls-rowiak.de/laser-based-histology/)。
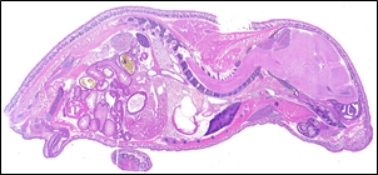
图1. 新生9天小鼠1um厚度矢状面切片的HE染色(川崎法制备)
传统的树脂包埋法主要采用基于甲基丙烯酸乙二醇酯(GMA)树脂或甲基丙烯酸甲酯(MMA)树脂的聚合反应,将脱水后的骨骼标本包裹在琥珀状透明、坚硬的包埋载体内,从而利用Leica Microtome系统(RM2255)达到固化切割的目的。目前MMA包埋法已经商品化,譬如利用光敏聚合反应的Technovit® 9100 Kit(EMS Catalog #14655),由德国-ELECTRON MICROSCOPYSCIENCES提供。
然而,传统的MMA包埋是通过聚合过程中产生的自由基对生物分子进行共价修饰,因而会导致组织中的酶活性和蛋白抗原性衰退,甚至几乎完全丧失。其无法可靠地用于组织化学或免疫组织化学,仅仅局限于对骨骼系统细胞形态和生长速率的观察和测定。所以为了解决这一技术的局限性,Tadafumi Kawamoto博士(日本横滨Tsurumi大学)于1981年创建了用于从硬组织和大样本中制作超薄切片的新型方法-川崎法,并于2008年优化升级(http://section-lab.jp/English/Goods.htm)。该项技术的核心在于运用自身研制的粘附薄膜与传统的冰冻切片相结合,将非脱钙的骨骼样本直接包埋并贴上薄膜进行直接切片,也可适用于尺寸较大的样品(如图1)。所获得切片样本可以直接进行免疫荧光和免疫组化染色,从而大大扩大了硬组织切片的应用范围。此外,德国Leica公司推出的Tape Transfer System(CRYOJANE; 39475205)也与川崎法具有异曲同工的效果,该系统实现了石蜡质量(2微米)的冰冻切片,且没有褶皱和压缩,完全完好无损,并与显微镜载玻片粘合在一起。
本实验室已熟练掌握川崎法切片准备手法,川崎法可缩短石蜡包埋中样本前期处理时间,在较短的时间内可以获得目的图片,并进行相应数据分析,我们在川崎法的基础上,选取小鼠的股骨进行组织切片,通过免疫荧光染色,可以清楚观察到生长板以及相应目的细胞所在位置。
基于以上各种不断改进的硬组织切片技术,我们还需要选取恰当的骨组织样本进行规范化的切片,采样点的标准化对于获得可重复性的结果,以及减少不同组别中个体化的差异也是尤为重要的。其中,大多数实验室选择股骨远端干骺端骨骼区域进行松质骨组织形态计量学方法。但是股骨远端的一个缺点是,与胫骨近端相比,生长板的形状更为复杂,很难规范化。所以最好将小鼠胫骨与腓骨同时包埋,降低其强烈弯曲所带来的断面标准化弊端。此外,小鼠腰椎的L4和L3也是最佳的测量区域,可以通过两侧的棘突的打开方式来确定冠状面区域的标准化(如图2),还可以解决高龄小鼠长骨中松质骨骨量有限的问题,被广泛采用。

图2. 小鼠腰椎的Von Kossa染色
骨组织形态特异性染色
当小伙伴们突破硬组织切片的瓶颈后,下一步便是如何利用这些组织样本来解析隐藏在CT分析之后的生物学信息了。在小鼠CT表型检测中,我们可以分析到骨结构参数如下:
· 松质骨体积 (trabecular bone volume, TBV)
· 骨小梁宽度 (trabecular width, Tb.Wi) 或厚度 (trabecular thickness, Tb.Th)
· 骨小梁数量 (trabecular number, Tb.N)
· 骨小梁分离度 (trabecular separation, Tb.Sp)
· 皮质骨厚度 (cortical width, Ct.Th) :两个内、外皮质外层平均宽度等
可以看出所有这些参数都只定位于骨骼的空间物理机构,无法给出细胞层面的病理解答。而骨组织形态计量学分析便可以直接观察骨生长和细胞构建的动静态变化,提供骨量测定(f放射学方法)和骨生化标志物(ELISA)都无法提供的消息,所以至今仍是骨代谢和骨矿化评价的金标准,无法取代。
显然这种技术的独特性是建立在骨骼标记和染色基础之上的,也可以说是不同染色体系成就了非脱钙硬组织切片技术的深度应用。目前常规的小鼠骨组织形态学染色主要涉及5大类,基本可以满足高水平论文的发表,分列如下:
1. 全景骨密度染色:通常采取Von Kossa染色法,利用银离子将骨骼系统的中的钙离子置换出来,从而达到骨骼组织呈现黑色的可视化(如图2)。
2. 类骨质成分染色:通过结合Von Kossa染色和Van Gieson染色的复染来辨别矿化骨和非矿化骨之间的差异,从而评估类骨质参数。
3. 成骨细胞/骨细胞体系染色:通常使用甲苯胺蓝染色辅以固绿的复染,从而进行成骨细胞和骨细胞的计数(如图3-右)。
4. 破骨细胞体系染色:通常使用最经典抗酒石酸酸性磷酸酶(TRAP)的染色法(如图3-左),将多核的破骨细胞染成红色进而提取计数。
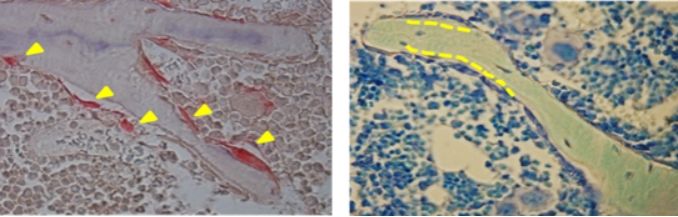
图3. 小鼠椎体松质骨非脱钙树脂切片的TRAP(图左)染色和甲苯胺蓝染色(图右)
5. 骨形成速率测定:主要采取钙黄绿素体内腹腔注射标记的方法。有些实验室使用两种不同的标签进行双重标记(如钙黄绿素和茜素红),然而,除非关注单个标签中所包含的生物学信息,否则两个不同的标签不会提供任何优势。使用适当的标记间隔是非常重要的,在可以测量的情况下,标记间隔必须尽可能短(一般不超过五天)。
分析软件及其测量方法
掌握了以上专业的硬组织切片技能和正确的细胞染色方法,我们就可以制备出相应的骨组织切片来进行骨组织形态学的测量了。对于非骨骼生物学领域的同行们,在表型较为明显的情况下,我们也通常可以考虑运用Image J对组织单位面积内骨量、细胞数量等参数进行简单的测量。但是对于发表高水平杂志特别是涉及骨生物学的专门内容,我们一定得遵循领域内的惯例,选择官方许可的软件平台对各骨骼参数进行准确、细致的分析。目前被官方认可、并被广泛使用的两款骨组织形态学主流测绘软件为:Osteomeasure (OsteoMetrics, Inc, US)和Bioquant-Osteo(国内代理:http://www.homer-tech.cn)。

图4. 经典的Osteomeasure系统
由于本人长期使用Osteomeasure系统(如图4), 感觉对于新人可能更容易上手和理解一些,尽管其在延展性和软件升级上略逊一筹,但是完全可以满足骨组织形态计量学中所涉及的参数(个人意见,无广告倾向,仅供参考)。Osteomeasure系统中包括了我们在发表文章中所需的几乎所有常用的骨骼重建(Bone Remodeling)参数,分为静态参数(提供非矿化和重吸收的程度)和动态参数(提供骨形成率和矿化的信息)两大部分(组织形态计量学参数的命名也是基于ASBMR命名委员会的标准)。主要常用的参数列举如下:
· 静态重建参数
类骨质表面 (osteoid surface, OS/BS) : 类骨质覆盖骨占骨表面的百分比
成骨细胞表面(osteoblast surface, Ob.S/BS) : 成骨细胞占骨表面的百分比
破骨细胞相对数量 (osteoclast number, No.Oc./B.Pm) : 破骨细胞在相对骨表面的数量
· 动态重建参数
矿化表面(mineralizing surface, MS/BS) : 标记骨小梁矿化表面占总骨小梁表面的百分比
矿化沉积率 (mineral apposition rate, MAR) : 骨小梁表面矿化层形成的速度, 由双标记间的距离除以标记间隔时间得到
骨形成率 (bone formation rate, BFR/BS) : 每单位时间内单位骨面形成新的骨量
需要特别强调的是,在正常情况下,松质骨组织形态计量学是在继发性海绵骨体内进行的,为了排除原发性海绵骨组织,在距生长板一定距离内的骨是被排除在分析之外(一般为一个视野)。通过软件完成以上数据的测绘,基本就可以解答我们文初所提出的科学问题“决定骨骼表型的生物学和细胞基础”即CT所无法完成解答的技能。



文末做个小广告:目前骨组织形态计量学平台已经在厦门大学-生物医学仪器共享平台建立完毕,可面向校内外进行定制服务,欢迎各兄弟单位选择使用。
※ 该篇文章为作者许韧教授原创,禁止一切形式的转载和商业使用,文献内的实验手法亦为作者许韧教授原创且并未授权给任何组织机构使用,如在使用该手法进行实验时出现任何事故,均与本单位无关且本单位会保留追究法律责任的权力。
